3.3. Estequiometria de las disoluciones y análisis químico
3.3. Estequiometria de las disoluciones y análisis químico.
Preparación de soluciones en el laboratorio
Ahora que ya conoces las distintas unidades de concentración, vamos a ver como es el proceso de preparación de soluciones:
- Procesos:
Preparación de soluciones a partir de reactivos sólidos:
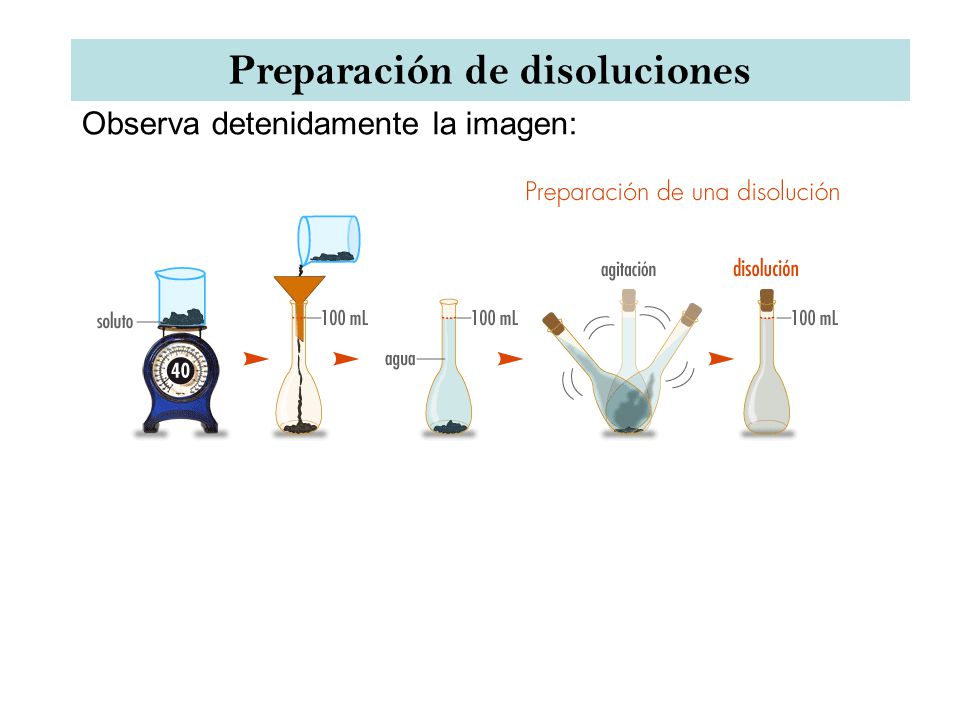 |
| Preparación de soluciones a partir de reactivos líquidos: |
- Observa los siguientes casos prácticos:
Actividad de aplicación (valor 50 ptos):
- En el laboratorio de tu colegio dispones de una disolución de NH3 al 10% m/m y de
d= 0,958 g/mL. El profesor te pide que prepares 500 mL de una disolución diluida
de amoníaco (NH3) de concentración 0,1 mol/L.
Calcula el volumen de amoníaco concentrado al 10% que debería tomar.
- De acuerdo con los vídeos indicados arriba, elabora un diagrama de flechas (con dibujos) del proceso de preparación de esta solución en el laboratorio (agrega los cálculos que realizaste y explica cada paso), sube tu diagrama en el siguiente formulario (Da clic aquí), puedes realizarlo en libreta o en formato digital, utiliza tu creatividad.
Comenta la resolución del ejercicio 1 en la parte de abajo y compara con la de tus compañeros (valor 50 ptos).

Si queremos preparar una solución 0,1 M significa que se tiene 0,1 mol de NH₃ en un litro de solución, entonces:
ResponderBorrar500 ml solución × ( 0,1 mol NH₃/L solución) × (1 L /1000 ml) = 0,05 mol NH₃
Necesitamos 0,05 mol NH₃ para preparar 500 ml de solución 0,1 M.
Calculamos cuánto necesitamos de la solución disponible para proporcionar 0,05 mol NH₃:
Peso molecular NH₃ = 17 g/mol0,05 mol NH₃ × 17 g /mol = 0,85 g NH₃
Sabemos que en la solución disponible tenemos 10% en masa de NH₃, entonces:
0,85 g NH₃ × (100 g solución inicial / 10 g NH₃) = 8,5 g solución inicial
Necesitamos 8,5 gramos de la solución inicial, dado que conocemos su densidad podemos calcular el volumen:
densidad = masa/ volumen ⇒ volumen = masa / densidad
volumen de solución inicial = 8,5 g / 0,958 g/ml = 9 ml
Se requieren 8.87 ml de la solución al 10% de NH₃,
Anthony Carrizales Loera
Ya que queremos preparar 0.1M sabemos: 0.1M=0.1mol/1L solución:
ResponderBorrar1. Hay que conocer los moles de NH3 para preparar la disolución:
500ml*(1molNH3/1L sol)*(1L/1000ml) = 0.05 mol NH3
2. Se calculan los gramos para la solución de 0.1M, es decir para los 0.05 mol
0.05molNH3*17g/mol(esta es la uma del NH3)= 0.85 g
3. Como hay 10% de masa
0.85 gNH3* (100g sol inicial/10g NH3)= 8.5 g solución inicial
4. Ya que tenemos la masa de la solución inicial y la densidad s ehace un despeje de fórmula para sacar el volumen:
v=m/densidad = 8.5 g/ 0.958g/ml = 8.87 ml
Ocupamos 8.87 ml de solución.
Salazar Castillo
BorrarCalcularemos los moles que se necesitan para preparar 500 ml de solución
ResponderBorrar500ml x 0.1 mol NH3/ 1 L x 1L/ 100ml= 0.05 mol NH3
Calcularemos los gramos de NH3
0.05mol NH3 x 17 g/ 1 mol= 0.85 g NH3
El problema nos proporciona la densidad, por lo que haremos uso de la formula siguiente:
d=m/v y como queremos calcular el volumen... v= m/d
Sustituyendo....
v= 8.5 g/ 0.958 g-ml
v= 9ml
En el laboratorio de tu colegio dispones de una disolución de NH3 al 10% m/m y de d= 0,958 g/mL. El profesor te pide que prepares 500 mL de una disolución diluida de amoníaco (NH3) de concentración 0,1 mol/L. Calcula el volumen de amoníaco concentrado al 10% que debería tomar
ResponderBorrarSOLUCIÓN:
sabemos que en 0.1M=0.1mol/1L solución:
Calculamos los moles de NH3 que son necesarios para preparar la disolución:
500ml de Sol. Con NH3(0.1mol deNH3/1L sol)(1L/1000ml)
= 0.05 mol NH3
Calculan los gramos para la solución de 0.1M, es decir para los 0.05 mol
(0.05molNH3)(17g/mol)= 0.85 g
*se elimina mol con mol.
Se sabe que hay 10% de masa
(0.85 gNH3) (100g sol inicial/10g NH3)
= 8.5 g solución inicial
Teniendo los datos anteriores y partiendo de la fórmula d= m/v y desoejandola para volumen tenemos que
v=m/d
v= 8.5 g/ 0.958g/ml = 8.87 ml ~ 9 ml
Garcia Martinez Carlos Alberto
Ocupamos 8.87 ml de solución.
1.- En el laboratorio de tu colegio dispones de una disolución de NH3 al 10% m/m y de d= 0,958 g/mL. El profesor te pide que prepares 500 mL de una disolución diluida de amoníaco (NH3) de concentración 0,1 mol/L. Calcula el volumen de amoníaco concentrado al 10% que debería tomar.
ResponderBorrarPM NH3= 17 g/mol
Moles necesarios:
500 ml solución( 0.1 moles NH3/ l sol)(1 l /1000 ml) = 0.05 moles NH3
Gramos de NH3:
0.05 moles NH3(17 g NH3/ 1 mol NH3)=0.85 g NH3
Por cada 100 g de solución hay 10 g de NH3:
(0.85 g NH3)(100 g solución inicial/10 g NH3)=8.5 g solución inicial
De la fórmula de densidad despejamos volumen y resolvemos
v=m/d = 8.5 g /0.958 g/ml = 8.87 ml de NH3 necesarios para preparar la disolución.
Isenia Elizabeth Martinez Camarillo
ResponderBorrarP R O C E D I M I E N T O:
Datos:
NH3= 17g/mol
Moles necesarios: 500 ml de solución (0.1 moles NH3/1 )(1L /100ml)=0.05 moles NH3
Gramos de NH3: (17g NH3/1 mol NH3)=0.85g NH3
(0.85g NH3)(100g solución inicial/10 g NH3)= 8.5g Solucion inical
De la forma de densidad despejamos el volumen y resolvemos:
v=m/d=8.5g/0.958g/ml
=8.87ml de NH3 necesarios para preparar la disolución.
Se tienen los siguientes datos:
ResponderBorrarC2= 10% m/m
d=0.958 g/mL
Vdis=500Ml=0.5L
C1=0.1 mol/L
PM=17 g/mol
V(NH3) al 10%=?
1. Primero se calculan los moles del NH3 y la masa, para ello se utiliza el valor de la concentración del NH3 y se multiplica por los L de la disolución es decir:
• Si C=mol/Litros de solución, entonces:
• [(0.1mol NH3/1L de disolución)(0.5 L de disolución)]= 0.05 moles
• Masa del NH3(m)= [(17g NH3/1 mol NH3)(0.05 moles NH3]= 0.85 g NH3
2. Tenemos que convertir la concentración C2 que está en 10%m/m, a C(m/v) para ello se dice que:
• Por cada 100g de solución inicial, hay 10 g de NH3
3. Por lo tanto utilizaremos el valor de la densidad de la disolución inicial y lo multiplicaremos por (10g NH3/ 100g solución inicial) que nos dará la C(m/v)
• C(m/v)=[(0.958 g solución inicial/1mL)(10g NH3/100g solución inicial)]
• = 0.0958 g NH3/mL
4. Por lo tanto C=m/v despejamos el volumen y nos quedaría v=m/C, sustituyendo quedaría:
• V(NH3)= [(0.85 g NH3)/(0.0958 g NH3/mL)]
• V(NH3)=8.87 mL NH3
Por lo tanto se necesitan 8.87ml de NH3 al 10% para preparar la disolución.
Contamos con la siguiente solución:
ResponderBorrarNH₃ al 10 % m/m (densidad = 0,958 g/ml )
Lo que se desea preparar
500 ml solución NH₃ 0,1 M
Para conocer los moles necesarios para preparar 500 ml de solución se hace la siguiente relación:
500 ml solución × ( 0,1 mol NH₃/L solución) × (1 L /1000 ml) = 0,05 mol NH₃
Es necesario conocer el peso molecular del compuesto:
Peso molecular NH₃ = 17 g/mol
0,05 mol NH₃ × 17 g /mol = 0,85 g NH₃
La solución está concentrada al 10% en masa de NH₃, entonces:
0,85 g NH₃ × (100 g solución inicial / 10 g NH₃) = 8,5 g solución inicial
Se necesitan 8,5 gramos de la solución inicial.
Ahora se despeja la fórmula de la densidad para sacar el volumen:
densidad = m/v
volumen = m/ d
volumen de solución inicial = 8,5 g / 0,958 g/ml = 8.87 ml
Se requieren 8.87 ml de la solución al 10% de NH₃, diluida hasta 500 ml para tener una solución 0,1 M.
Para este problema tenemos los siguientes datos:
ResponderBorrarPara preparar una solución 0,1 M de concentración, lo cual significa que se tiene 0,1 mol de NH3 en un litro de solución, por lo tanto , con estos datos obtuve los moles de NH3, con una ecuacion adimensional:
500 ml solución × ( 0,1 mol NH3/L solución) × (1 L /1000 ml) = 0,05 mol NH3
por lo tanto 0,05 mol NH3 para preparar 500 ml de solución 0,1 M.
Con los 0,05 mol NH3 y con la ayuda del PM del NH3, calcule los gramos que se necesitan:
0,05 mol NH3 × 17 g /mol = 0,85 g NH3
Como tiene una concentración de 10% en masa de NH3, calcule los gramos en esa concentración:
0,85 g NH₃ (100 g solución inicial / 10 g NH₃) = 8,5 g
Con el dato de la densidad, y despejando la formula de la misma, obtuve el volumen
V = 8,5 g / 0,958 g/ml= 8.87 ml
Por lo tanto, se dice que se necesita de 8.87mL de la disolución inicial para preparar 500ml de la disolución solicitada, con concentración de 0,1M.
Datos
ResponderBorrarSolución disponible:NH₃ al 10 % m/m (densidad = 0,958 g/ml )
Solución deseada: 500 ml solución NH₃ 0,1 M
Calcular Moles
500 ml solución × ( 0,1 mol NH₃/L solución) × (1 L /1000 ml) = 0,05 mol NH₃
Calcular los gramos
Peso molecular NH₃ = 17 g/mol
0,05 mol NH₃ × 17 g /mol = 0,85 g NH₃
0,85 g NH₃ × (100 g solución inicial / 10 g NH₃) = 8,5 g solución inicial
Con los datos anteriores utilizamos la siguiente fórmula
densidad = masa/ volumen
volumen = masa / densidad
volumen de solución inicial = 8,5 g / 0,958 g/ml = 9 ml
Por lo tanto se requerirán 9 ml de NH3
Se obtienen los moles de NH3
ResponderBorrar500 ml solución × ( 0,1 mol NH3/L solución) × (1 L /1000 ml) = 0,05 mol NH3
Entonces, se necesitan 0,05 mol NH3 para preparar 500 ml de solución 0,1 M.
Con los 0,05 mol NH3 y con la ayuda del PM del NH3, se calculan los gramos que se necesitan:
0,05 mol NH3 × 17 g /mol = 0,85 g NH3
Como se tiene una concentración de 10% en masa de NH3, se calculan los gramos en esta concentración:
0,85 g NH₃ (100 g solución inicial / 10 g NH₃) = 8,5 g
Se despeja la formula de la densidad y se obtiene que:
V = 8,5 g / 0,958 g/ml= 8.87 ml
Se necesita de 8.87mL de la disolución inicial para preparar 500ml de la disolución solicitada, con concentración de 0,1M.
Trejo Rosales Eric Jonatan
Ariel Alejandro Velazquez Sanchez
ResponderBorrar500 ml solución × ( 0,1 mol NH₃/L solución) × (1 L /1000 ml) = 0,05 mol NH₃
Calculamos cuánto necesitamos de la solución disponible para proporcionar 0,05 mol NH₃:
Peso molecular NH₃ = 17 g/mol
0,05 mol NH₃ × 17 g /mol = 0,85 g NH₃
0,85 g NH₃ × (100 g solución inicial / 10 g NH₃) = 8,5 g solución inicial
densidad = masa/ volumen ⇒ volumen = masa / densidad
volumen de solución inicial = 8,5 g / 0,958 g/ml = 9 ml
Peña Garza Yesenia
ResponderBorrarDATOS:
0,1 mol de NH3
Densidad: 0,958g/ml
Ecuacion adimensional
500ml solución × (0,1 molNH3/L. Solu) x (1L/1000ml) = 0.05molNH3
Gramos que se necesitan:
0.05molNH3 x 17g/mol = 0,85gNH3 con una concentración del 10% en masa, Calcule los gramos en esa concentración...
0,85gNH3x (100 solu. Inicial/10NH3) = 8,5g
V= 8,5g/ 0,958g/ml = 8.87 ml para preparar los 500ml de la disolución inicial con 0,1m de concentración.
Sarmiento Hernandez Sara Itzel
ResponderBorrar17 g/mol NH3
500 ml solución( 0.1 moles NH3/ l sol)(1 l /1000 ml) = 0.05 moles NH3
Gramos de NH3:
0.05 moles NH3(17 g NH3/ 1 mol NH3)=0.85 g NH3
Por cada 100 g de solución hay 10 g de NH3:
(0.85 g NH3)(100 g solución inicial/10 g NH3)=8.5 g solución inicial
Se despeja la fórmula para sacar los ml
v=m/d = 8.5 g /0.958 g/ml =
8.87 ml de NH3 necesarios para preparar la disolución.
EscobedoMartinezFernanda
ResponderBorrarPara esto nuestra Solución disponible:
NH₃ al 10 % m/m (densidad = 0,958 g/ml )
Solución deseada:
500 ml solución NH₃ 0,1 M
Si queremos preparar una solución 0,1 M significa que se tiene 0,1 mol de NH₃ en un litro de solución entonces sabemos que
500 ml solución × ( 0,1 mol NH₃/L solución) × (1 L /1000 ml) = 0,05 mol NH₃
Necesitamos 0,05 mol NH₃ para preparar 500 ml de solución 0,1 M.
Calculamos cuánto necesitamos de la solución disponible para proporcionar 0,05 mol NH₃:
Peso molecular NH₃ = 17 g/mol
0,05 mol NH₃ × 17 g /mol = 0,85 g NH₃
Sabemos que en la solución disponible tenemos 10% en masa de NH₃, entonces:
0,85 g NH₃ × (100 g solución inicial / 10 g NH₃) = 8,5 g solución inicial
Necesitamos 8,5 gramos de la solución inicial, dado que conocemos su densidad podemos calcular el volumen.
volumen de solución inicial = 8,5 g / 0,958 g/ml = 9 m
NH₃ al 10 % m/m (densidad = 0,958 g/ml )
ResponderBorrar1- Los moles que se necesitan para preparar 500 ml de solución
(500ml)(0.1 mol NH3)/ 1 L ( 1L/ 100ml)= 0.05 mol NH3
2- gramos de NH3
(.05mol NH3)( 17 g)/ 1 mol= 0.85 g NH3
3- v= m/p se utiliza la formula de densidad pero en este caso, de ella se despeja para sacar el volumen
v= 8.5 g/ 0.958 g-ml
v= 8.87 mL NH3
Por lo tanto se necesitan 8.87ml de NH3 al 10% para preparar la disolución.
17 g/mol NH3
ResponderBorrar500 ml solución( 0.1 moles NH3/ l sol)(1 l /1000 ml) =
0.05 moles NH3
0.05 moles NH3(17 g NH3/ 1 mol NH3)=
0.85 g NH3
Por cada 100 g de solución hay 10 g de NH3:
(0.85 g NH3)(100 g solución inicial/10 g NH3)=
8.5 g solución inicial
v=m/d
8.5 g /0.958 g/ml =
8.87 ml de NH3 necesarios para preparar la disolución.
Datos
ResponderBorrarSolución de NH₃ al 10 % m/m (densidad = 0,958 g/ml )
Solución deseada: 500 ml solución NH₃ 0,1 M
Calcular Moles
500 ml solución ( 0,1 mol NH₃/L solución) (1 L /1000 ml) = 0,05 mol NH₃
Calcular los gramos
Peso molecular NH₃ = 17 g/mol
(0,05 mol NH₃ )( 17 g /mol) = 0,85 g NH₃
(0,85 g NH₃) (100 g solución inicial / 10 g NH₃) = 8,5 g solución inicial
Se utilizara la sig formula
densidad = masa/ volumen
volumen = masa / densidad
volumen de solución inicial = 8,5 g / 0,958 g/ml = 9 ml
9ml de requieres para NH3
-Carrillo Morales Lourdes Marcela
Datos
ResponderBorrarsolucion de NH3 al 10%
d= 0.958 g/ml
500 ml solucion deseada
concentración = 0.1 mol/L
v= ?
pm= 17g/mol
Solución
500 ml (0.1 mol/L)/(1 L/ 1000 ml)= 0.05 mol
0.05 mol (17 g/mol) = 0.85 g NH3
0.85NH3 (100 g solucion inicial /10g NH3)= 8.5 g
v= 8.5 g/ 0.958 g/ml
v= 8.87 ml
Daniela Martinez Rodriguez
En el laboratorio de tu colegio dispones de una disolución de NH3 al 10% m/m y de d= 0,958 g/mL. El profesor te pide que prepares 500 mL de una disolución diluida de amoníaco (NH3) de concentración 0,1 mol/L. Calcula el volumen de amoníaco concentrado al 10% que debería tomar.
ResponderBorrarPrimero que nada, debería saber cuántos moles necesito para preparar la solución de 500mL
Entonces se harían las siguientes operaciones
(500ml)(0.1molNH3)/1 L(1L/100ml)= 0.05molNH3
Después, los gramos de NH3
(.05molNH3)(17g)/1mol=0.85gNH3
Y para finalizar, utilizamos v= m/p
v= 8.5 g/ 0.958 g-ml
v= 8.87 mL NH3
Y esto (8.87mL) sería lo necesario par preparar la disolución
17 g/mol NH3
ResponderBorrar500 ml solución( 0.1 moles NH3/ l sol)(1 l /1000 ml) = 0.05 moles NH3
NH3 g:
0.05 moles NH3(17 g NH3/ 1 mol NH3)=0.85 g NH3
cada 100 g de solución hay 10 g de NH3:
(0.85 g NH3)(100 g solución inicial/10 g NH3)=8.5 g solución inicial
formula
v=m/d = 8.5 g /0.958 g/ml =
8.87 ml de NH3 necesarios
Este comentario ha sido eliminado por el autor.
ResponderBorrar1. Se calculará la cantidad de moles que se necesitan para 500ml de solución:
ResponderBorrar500 ml solución × (0.1 mol NH₃/L solución) × (1 L /1000 ml) = 0.05 mol NH₃
2. Enseguida se calculará los gramos de NH₃: PM NH₃= 17g/mol 0.05mol NH₃ x 17g/mol= 0.85g NH₃
3. La solución disponible tenemos 10% en masa de NH₃…
0.85g NH₃ x (100g solución inicial / 10g NH₃) = 8.5g solución inicial
4. Para calcular el volumen se usará la fórmula de la densidad: d= m/v. Despejaremos el volumen y queda de la siguiente manera: v= m/d. Sustituimos los datos….
V= (8.5g solución inicial) / 0.958g/ml= 8.87 ml
5. Se necesitan 8.87ml de NH₃.
Maldonado Sánchez
Después de acomodar los datos, nos damos cuenta que tenemos que sacar los moles de NH3:
ResponderBorrar°500 ml(0.1 mol/ 1 L de sol.)*(1 L/ 1000 mL) = 0.05 mol NH3
Con ayuda de los moles y el PM de NH3, sacamos los gramos:
°(17 g/mol)*(0.05 mol)= 0.85 g
Sacaremos los gramos de la solución inicial con el dato de 10%m/m
° 0.85g(100 g/10g)= 8.5 g
Utilizaremos la fórmula de la densidad para sacar el volumen:
° ρ = m/v ----> v= m/ ρ
°v = 8.5 g/(0.958 g/ml)= 8.87 ml <----- Ese es el volumen que se necesita al concentrado 10%
Disolucion = 500ml
ResponderBorrar0.1M=0.1mol/1L de sol.
n(NH3)=(500ml)(1molNH3/1L sol)(1L/1000ml) = 0.05 mol de NH3
m(dis)=(0.05 mol de NH3)(17g/mol de NH3)= 0.85 g de dis.
m(10%)=(0.85g de NH3)(100g de dis/10g de NH3)= 8.5 g de dis.
V= (8.5 g)/( 0.958g/ml) = 8.8727 ml
Para preparar una solución 0.1 M quiere decir que se tiene 0.1 mol de NH3 en un litro de solución
ResponderBorrar-Tenemos que conocer los moles de NH3 = 500mL(1mol NH3/1L Solución)(1L/1000ml)=0.05 mol NH3
-Calculamos los gramos para dicha cantidad (0.05 mol NH3) = (0.05 mol NH3)*(17g/mol)= 0.85g
-Como la solución tiene solo un 10% de masa=(0.85g NH3)(100g Sol/10g NH3)= 8.5g solución inicial
- Se colocan los valores obtenidos en la fórmula V=M/D (densidad)= 8.5g/(0.958g/ml)= 8.87 ml
0.1 mol de NH3
ResponderBorrarDensidad: 0.958g/ml
____________________________________________________________________________
500 mL. solución con NH3 (0.1 mol NH3/1 l solucion)(1 l de solucion/ 1000 mL.)=0.05 mol NH3
(0.05 mol NH3)(17g/mol)=0.85
(0.85 g NH3)(100 g de solución inicial/10 g NH3)=8.5 g
d=m/V
v=m/d v=8.5g/0.958 g/mL.= 8.87 mL
para poder tener una solución de NH3 al 10% se tienen que seguir estos pasos.
ResponderBorrar1- (500ml)(0.1 mol NH3)/ 1 L ( 1L/ 100ml)= 0.05 mol NH3
2- (.05mol NH3)( 17 g)/ 1 mol= 0.85 g NH3
3-v= 8.5 g/ 0.958 g-ml = 8.87 mL NH3
esto significa que se necesitan 8.87 ml de NH3 para poder tener una disolución del 10%
Guerrero Alexander
Datos
ResponderBorrarSolución disponible:NH₃ al 10 % m/m (densidad = 0,958 g/ml )
Solución deseada: 500 ml solución NH₃ 0,1 M
Calcular Moles
500 ml solución × ( 0,1 mol NH₃/L solución) × (1 L /1000 ml) = 0,05 mol NH₃
Calcular los gramos
Peso molecular NH₃ = 17 g/mol
0,05 mol NH₃ × 17 g /mol = 0,85 g NH₃
0,85 g NH₃ × (100 g solución inicial / 10 g NH₃) = 8,5 g solución inicial
Fórmulas
densidad = masa/ volumen
volumen = masa / densidad
volumen de solución inicial = 8,5 g / 0,958 g/ml = 9 ml
Requerirán 9 ml de NH3
HERNANDEZ NAVA MARIA FERNANDA
ResponderBorrarSolución disponible:
NH₃ al 10 % m/m (densidad = 0,958 g/ml )
Solución deseada:
500 ml solución NH₃ 0,1 M
Si queremos preparar una solución 0,1 M significa que se tiene 0,1 mol de NH₃ en un litro de solución, entonces:
500 ml solución × ( 0,1 mol NH₃/L solución) × (1 L /1000 ml) = 0,05 mol NH₃
Necesitamos 0,05 mol NH₃ para preparar 500 ml de solución 0,1 M.
Calculamos cuánto necesitamos de la solución disponible para proporcionar 0,05 mol NH₃:
Peso molecular NH₃ = 17 g/mol
0,05 mol NH₃ × 17 g /mol = 0,85 g NH₃
Sabemos que en la solución disponible tenemos 10% en masa de NH₃, entonces:
0,85 g NH₃ × (100 g solución inicial / 10 g NH₃) = 8,5 g solución inicial
Necesitamos 8,5 gramos de la solución inicial, dado que conocemos su densidad podemos calcular el volumen:
densidad = masa/ volumen ⇒ volumen = masa / densidad
volumen de solución inicial = 8,5 g / 0,958 g/ml = 9 ml
Se requieren 9 ml de la solución al 10% de NH₃, diluida hasta 500 ml para tener una solución 0,1 M.
500ml de solución
ResponderBorrar500ml(0.1 mol NH3)/1 (1L)/1000ml= 0.05 mol NH3
Gramos de NH3
0.05 mol NH3 (17g)/1 mol= 0.85g NH3
d=m/v
v=m/d v=8.5g/0.958g/ml=9ml
Contamos con la siguiente solución:
ResponderBorrarNH₃ al 10 % m/m (densidad = 0,958 g/ml )
Lo que se desea preparar
500 ml solución NH₃ 0,1 M
Para conocer los moles necesarios para preparar 500 ml de solución se hace la siguiente relación:
500 ml solución × ( 0,1 mol NH₃/L solución) × (1 L /1000 ml) = 0,05 mol NH₃
Es necesario conocer el peso molecular del compuesto:
Peso molecular NH₃ = 17 g/mol
0,05 mol NH₃ × 17 g /mol = 0,85 g NH₃
La solución está concentrada al 10% en masa de NH₃, entonces:
0,85 g NH₃ × (100 g solución inicial / 10 g NH₃) = 8,5 g solución inicial
Se necesitan 8,5 gramos de la solución inicial.
Ahora se despeja la fórmula de la densidad para sacar el volumen:
densidad = m/v
volumen = m/ d
volumen de solución inicial = 8,5 g / 0,958 g/ml = 8.87 ml
Se requieren 8.87 ml de la solución al 10% de NH₃, diluida hasta 500 ml para tener una solución 0,1 M.
Erick Guillermo Puente Alvizo
Martinez Castillo Luz Paola
ResponderBorrarDatos
solucion de NH3 al 10%
d= 0.958 g/ml
500 ml solucion deseada
concentración = 0.1 mol/L
v= ?
pm= 17g/mol
Solución
500 ml (0.1 mol/L)/(1 L/ 1000 ml)= 0.05 mol
0.05 mol (17 g/mol) = 0.85 g NH3
0.85NH3 (100 g solucion inicial /10g NH3)= 8.5 g
v= 8.5 g/ 0.958 g/ml
v= 8.87 ml
Maria G Salinas Martínez
ResponderBorrarContamos con la siguiente solución:
NH₃ al 10 % m/m (densidad = 0,958 g/ml )
Lo que se desea preparar
500 ml solución NH₃ 0,1 M
Para conocer los moles necesarios para preparar 500 ml de solución se hace la siguiente relación:
500 ml solución × ( 0,1 mol NH₃/L solución) × (1 L /1000 ml) = 0,05 mol NH₃
Es necesario conocer el peso molecular del compuesto:
Peso molecular NH₃ = 17 g/mol
0,05 mol NH₃ × 17 g /mol = 0,85 g NH₃
La solución está concentrada al 10% en masa de NH₃, entonces:
0,85 g NH₃ × (100 g solución inicial / 10 g NH₃) = 8,5 g solución inicial
Se necesitan 8,5 gramos de la solución inicial.
Ahora se despeja la fórmula de la densidad para sacar el volumen:
densidad = m/v
volumen = m/ d
volumen de solución inicial = 8,5 g / 0,958 g/ml = 8.87 ml
Se requieren 8.87 ml de la solución al 10% de NH₃, diluida hasta 500 ml para tener una solución 0,1 M.
Tenemos los datos:
ResponderBorrarNH3=17g/mol
Fórmula:
d=m/v
Procedimiento:
500ml de solución a partir de esos ml calcular los moles necesarios para preparar la solución
(0.1moles de NH3/1)(1L/100ml)=0.05moles de NH3
gramos de NH3:
(17g NH3/1molNH3)=0.85gNH3
(0.85gNH3)(100g de sol. Inicial/10gNH3)=8.5g de sol. Inicial
Despejando la fórmula de densidad para calcular el volumen queda:
V=m/d=8.5g/0.958g/ml=8.87ml de NH3 necesarios.